炎症性肠病(inflammatory bowel disease,IBD)是一种特发性的免疫病变。IBD的主要表现为体质量减轻、带血腹泻、持续腹泻、腹痛。虽然IBD的具体发病机制尚不完全清楚,但通常认为平衡系统的破坏,包括氧化系统、免疫系统、肠道屏障和肠道菌群,是IBD发展的主要因素。正常情况下,位于肠道表面的肠上皮细胞可以阻止外来有害物质进入肠腔,维持肠道内稳态。氧化应激是体内氧化和抗氧化作用之间的不平衡状态,具有氧化倾向。氧化应激可导致高活性分子活性氧(reactive oxygen species,ROS)的过量产生。肠道中过量暴露于ROS会促进促炎因子的产生,导致肠道炎症。同时,氧化应激可激活NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体,促进炎症,最终破坏结肠黏膜结构,诱发IBD。此外,肠道微生物在提高机体免疫力、修复肠道屏障、抑制肠道病原体等方面发挥着至关重要的作用。然而,肠道微生物群的失衡,如变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)比例增加,导致慢性炎症和代谢功能障碍,最终破坏肠道屏障。同时,微生物产生的短链脂肪酸(short-chain fatty acids,SCFAs)能够通过多种靶点影响肠道健康。因此,肠道微生物的变化和结肠黏膜的破坏在IBD的恶化中起着至关重要的作用。胞外多糖是微生物生长过程中分泌在细胞外的重要代谢物。胞外多糖(exopolysaccharides,EPSs)因其“被普遍认为是安全的”和多样化的功能特征而引起了很大关注。研究表明,EPSs参与肠道屏障的修复和肠道菌群的调节。这些发现表明,将EPSs作为一种新兴物质用于IBD治疗的可能性。双歧杆菌(Bifidobacterium)被认为是人体肠道中重要的益生菌,对肠道炎症的缓解作用已被临床和动物实验证实。其中,EPS分泌功能在双歧杆菌中也很常见。双歧杆菌分泌的EPSs也被认为是其益生菌作用机制的主要组成部分。例如,来自B. breve lw01的EPS通过调节细胞周期和促进细胞凋亡发挥抗癌作用。动物双歧杆菌的EPS通过减少凋亡和促进自噬泡形成来减轻大肠杆菌诱导的IPEC-2细胞损伤。来自于B. longum W11的EPS显著增加H2O2诱导的人肺成纤维细胞中的巯基,同时有效降低细胞内ROS的含量。有研究证实,高产EPS的B. breve H4-2通过降低肠道氧化应激水平,能够有效修复葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎。然而,H4-2分泌的EPS在肠道氧化应激中的具体作用尚不清楚。因此,东北农业大学食品学院、乳品科学教育部重点实验室的Niu Mengmeng(第一作者)、孟祥晨(通信作者)等将H2O2诱导的IEC-6细胞损伤与DSS诱导的小鼠结肠炎相结合,揭示B.
breve H4-2分离的胞外多糖(exopolysaccharide from B. breve H4-2,BBE)在修复肠道屏障和调节肠道菌群中的潜在作用。基本成分分析表明,BBE的总碳水化合物含量为80.73%,蛋白质含量为4.31%,醛酸含量为2.07%,硫酸盐含量为3.37%。BBE主要由甘露糖、鼠李糖、葡萄糖、乙酰氨基葡萄糖和半乳糖组成,物质的量比为1.00:0.76:1.79:1.03:0.63(图1A)。紫外-可见光谱(图1B)显示,BBE在280 nm处有1 个小的吸收峰,这表明BBE含有少量蛋白质,证实BBE结构中存在氨基糖。FTIR光谱分析显示了BBE的典型多糖特征吸收峰(图1C)。例如,3 396.74 cm-1处的吸附峰对应于强烈的羟基(O—H)拉伸振动。在2 933.10 cm-1处出现一个弱吸附带,这是由于C—H和C—O键的拉伸晃动所致。1 651.02 cm-1附近的峰值预示C=O键的存在。此外,在1 562.54 cm-1处有1 个较弱的吸附带,与酰胺基团的拉伸振动一致,表明BBE中存在蛋白质。1 250.28 cm-1处的吸附带可能是由于S=O拉伸振动而出现的,表明BBE中存在硫酸盐基团。1 056.96 cm-1处的吸附带被认为是C—O的拉伸振动。最后,872.14 cm-1处的小吸附带被认为是α-半乳糖拉伸振动的特征。采用紫外-可见分光光度仪测定含有0.15 mol/L NaOH的刚果红-BBE溶液的λmax,以加入0.15 mol/L NaOH的刚果红为阴性对照。与对照相比,BBE在486~499 nm范围内出现了明显的红移(图1D),表明BBE具有三链螺旋结构。如图1E所示,H2O2作用于IEC-6细胞2 h后,细胞活力从100%下降到21.64%,表明H2O2对IEC-6细胞具有剂量依赖性的毒性作用。当H2O2浓度超过200 μmol/L时,IEC-6细胞存活率未见明显下降。因此,选用H2O2(200 μmol/L)诱导IEC-6细胞氧化损伤。同时,通过预处理IEC-6细胞24 h,评价BBE (0~800 μg/mL)的有效水平。不同质量浓度的BBE可显著提高IEC-6细胞的活力(P<0.001)。然而,当BBE质量浓度超过600 μg/mL时,IEC-6细胞的活力略有下降(图1F)。因此,在进一步的实验中,BBE的质量浓度为0~600 μg/mL。如图1G所示,单独暴露于H2O2后,IEC-6细胞的存活率显著下降至52.96%(P<0.01)。然而,不同质量浓度的BBE H2O2共孵育后,细胞活力呈剂量依赖性增加。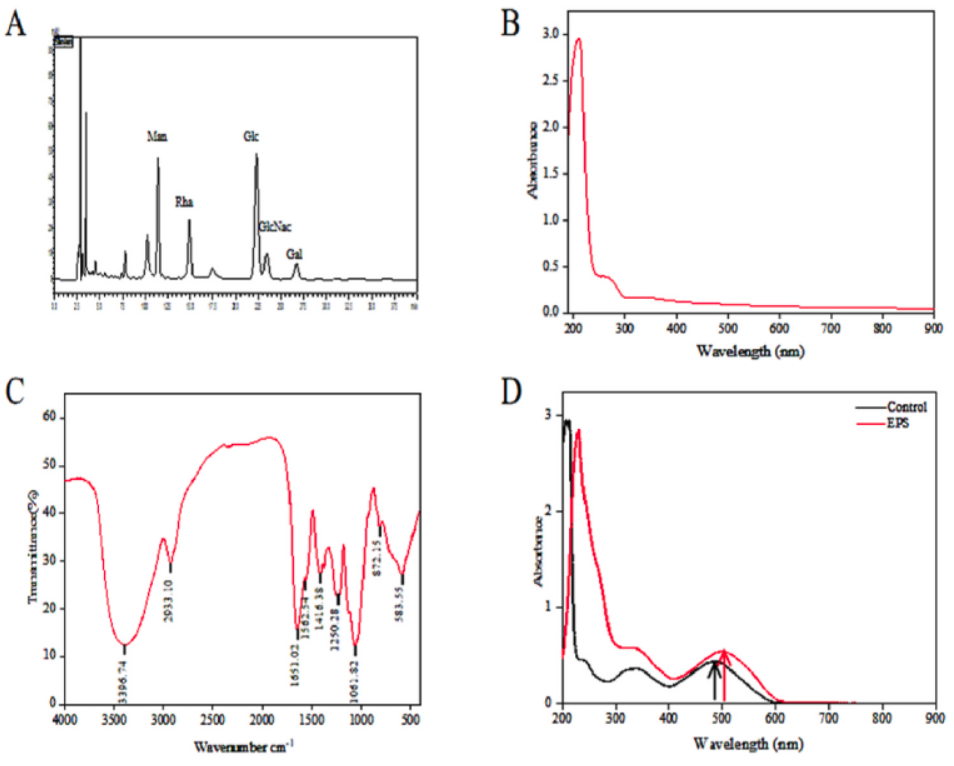
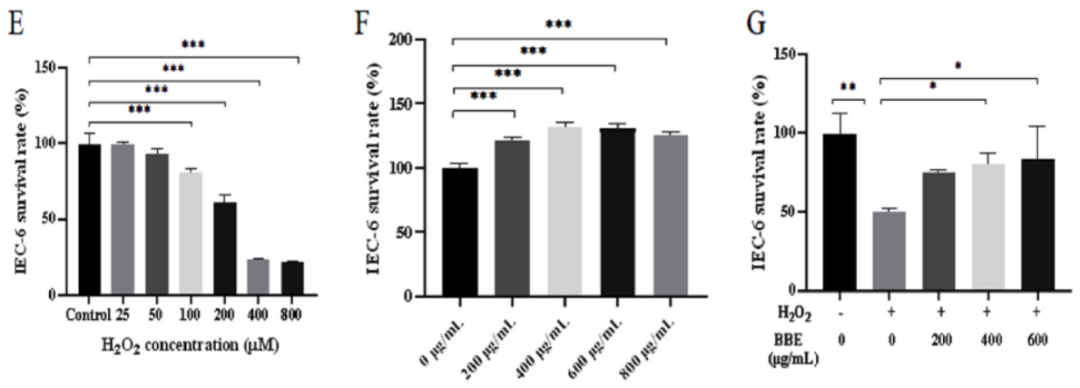
***:P<0.001,**:P<0.01,*:P<0.05。单因素方差分析后进行Tukey多重比较检验。下同。图1 BBE的结构表征,包括色谱(A)、紫外光谱(B)、红外光谱(C)和刚果红分析(D),以及H2O2对IEC-6细胞活力的影响(E)、BBE对IEC-6细胞活力的影响(F)和BBE对H2O2诱导的IEC-6细胞活力的影响(G)体质量减轻是IBD结肠炎的主要临床症状。与NC组相比,DSS组小鼠体质量减轻近20%。然而,BBE干预组表现出体质量减轻的减少(图2A)。疾病活动指数(disease activity index,DAI)和结肠长度减少是评估结肠炎程度的常用参数。在本研究中,与对照组(normal control,NC)小鼠相比,DSS处理的小鼠DAI明显增加,结肠长度明显缩短(P<0.001)(图2B和C)。然而,相对于DSS处理的小鼠,BBE处理的小鼠DAI表现出明显的降低(P<0.001),结肠长度显著增加(P<0.01)。D-乳酸含量的变化可以作为小鼠肠通透性对BBE治疗的反应。与NC组相比,DSS组结肠内D-乳酸质量浓度显著升高(P<0.001),而BBE干预组D-乳酸含量显著降低(P<0.01)(图2E)。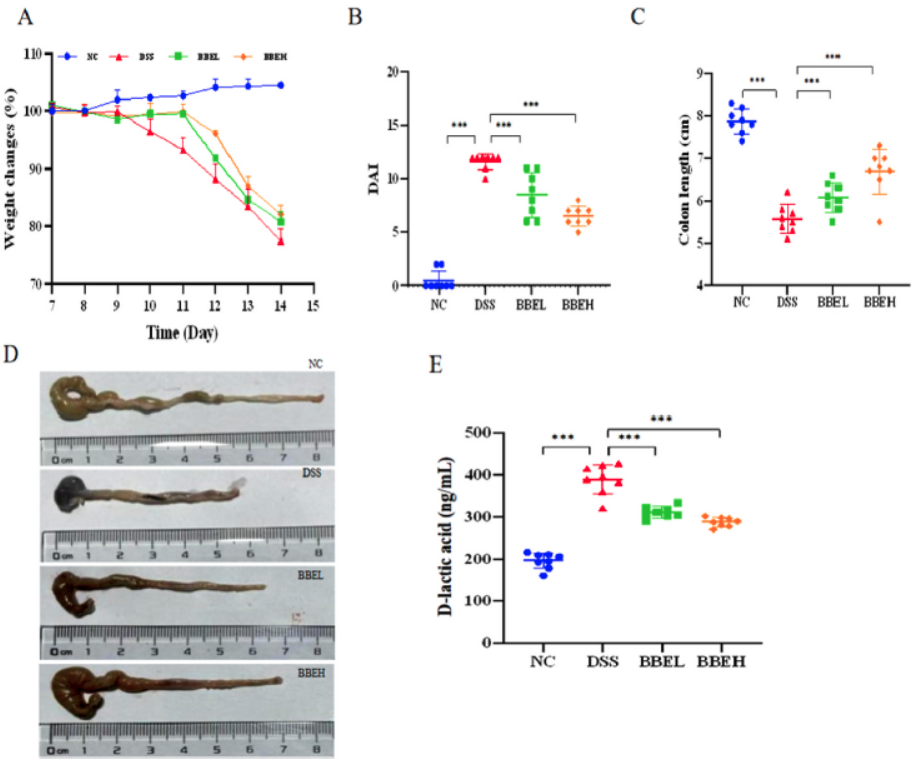
图2 BBE干预后小鼠体质量(A)、DAI(B)、结肠长度(C)、结肠宏观图片(D)、D-乳酸质量浓度(E)的变化
NC组小鼠结肠组织完整,隐窝正常。无炎症细胞浸润,杯状细胞中黏蛋白含量丰富(图3A和B)。相反,DSS组小鼠结肠隐窝受损,结肠上皮绒毛丢失,炎症细胞浸润,肠黏膜下水肿,结肠黏蛋白大量丢失。然而,BBE给药后,结肠组织结构和损伤症状得到缓解,杯状细胞明显增加(图3D)(P<0.01)。结肠黏液层成分的减少加重了结肠炎的症状。muc-2的mRNA表达情况如图3E所示,与NC组结肠组织相比,DSS组muc-2表达显著降低(P<0.01)。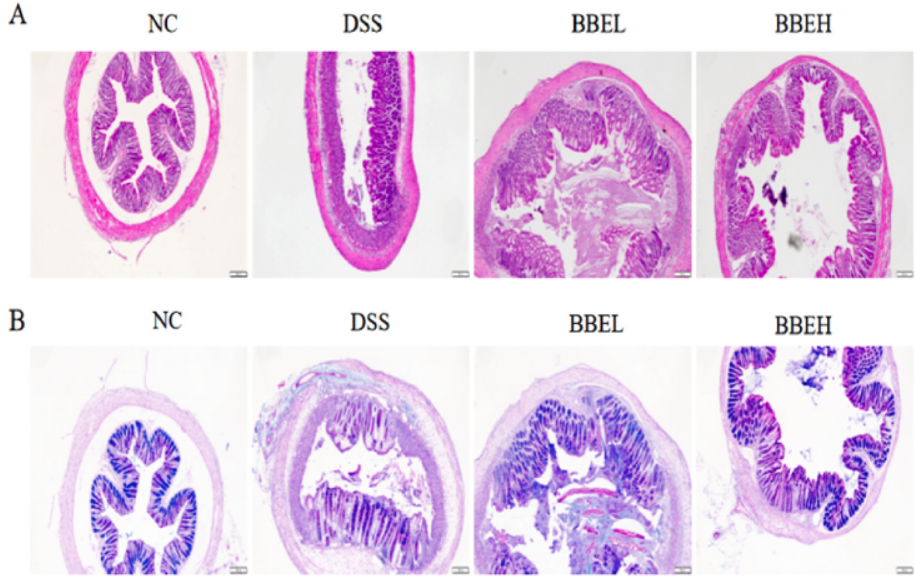
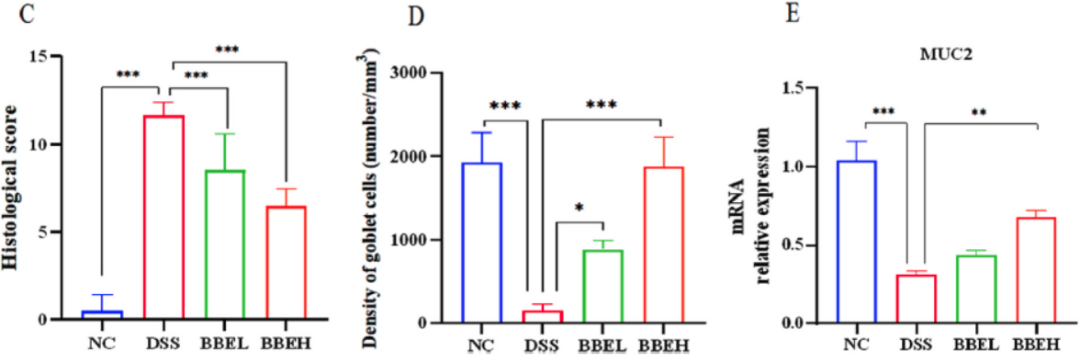
图3 BBE干预对小鼠结肠H&E(A)和AB-PAS(B)染色组织切片、组织病理学评分(C)、杯状细胞数量(D)和muc-2 mRNA表达(E)的影响DSS处理小鼠结肠组织中IL-6、IL-1β和TNF-α含量明显高于NC小鼠(P<0.05)(图4A、C、D)。然而,BBE干预强烈抑制了结肠组织中细胞因子的上调。此外,DSS处理后结肠组织中IL-10水平也明显降低(图4B)(P<0.01),但BBE干预明显抑制降低。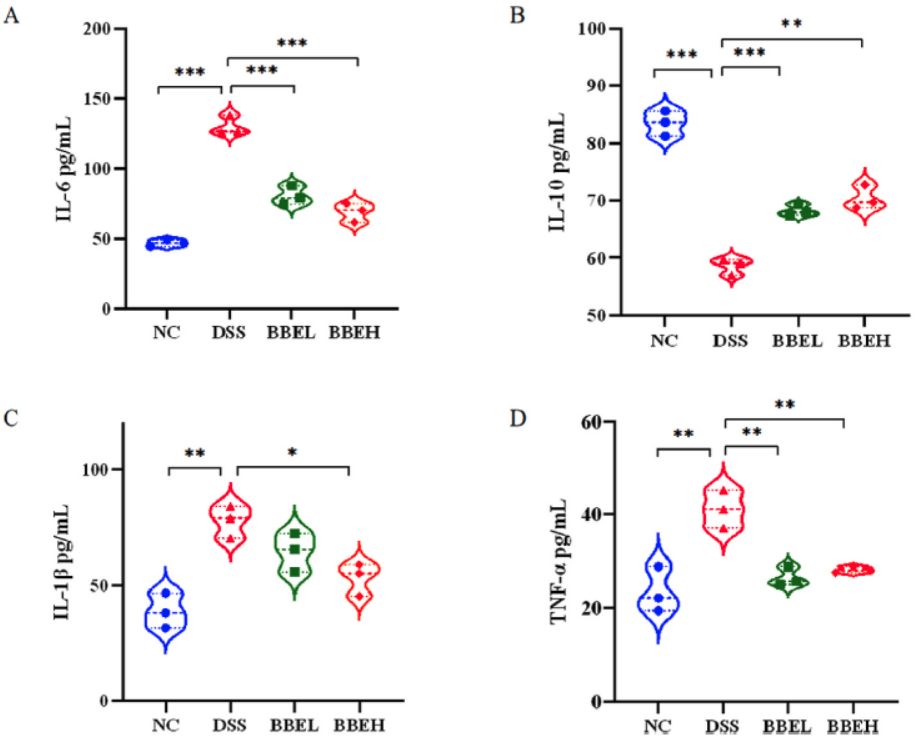
图4 BBE干预后结肠炎小鼠结肠组织中IL-6(A)、IL-10(B)、IL-1β(C)、TNF-α(D)水平的变化
与NC组比较,DSS治疗组小鼠结肠ZO-1、Occludin、Claudin-1免疫组化染色图像中几乎没有阳性细胞,同时免疫组化评分显著降低(P<0.01)(图5)。但BBE干预能够明显减少损害。同样,在紧密连接(tight junctions,TJs)的mRNA表达中也检测到类似的趋势。其中,BBEH(400 mg/mL BBE)干预小鼠结肠Occludin mRNA表达与NC组相似。一般情况下,Claudin-1主要出现在结肠上皮细胞的细胞膜上。BBE干预组Claudin-1 mRNA表达明显高于DSS组(P<0.01)(图5I)。BBEH的修复效果优于NC组。基于上述3 种蛋白的mRNA表达,BBE可有效修复DSS诱导的小鼠肠上皮屏障损伤。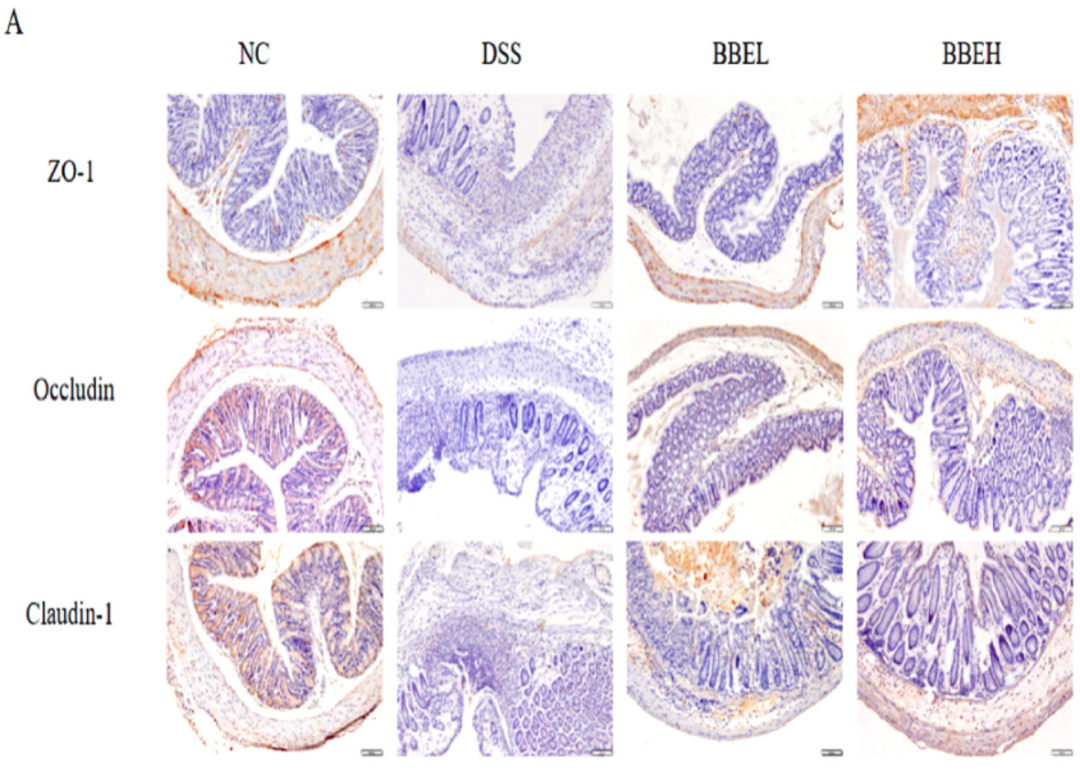
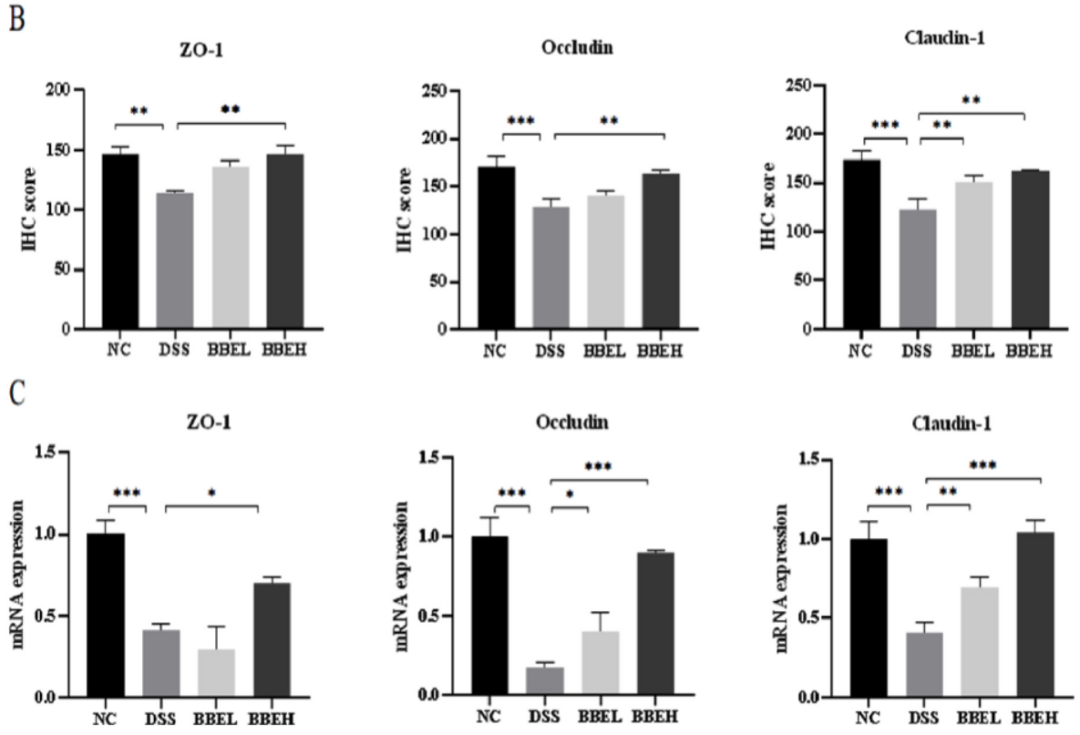
图5 BBE对上皮屏障的影响,包括TJs的免疫组化染色(A)、免疫组化评分(B)和TJsmRNA表达(C)
氧化应激在结肠炎的发病和发展中起重要作用。因此,我们评估了BBE对DSS处理小鼠氧化失衡的修复作用。经BBE干预后,DSS诱导的低谷胱甘肽(glutathione,GSH)含量、高氧化型谷胱甘肽(oxidized glutathione,GSSG)含量和低GSH/GSSG比值得到改善(图6A-C)。此外,DSS增加了小鼠结肠中髓过氧物酶(myeloperoxidase,MPO)和丙二醛(malondialdehyde,MDA)的含量,而BBE干预改善效果明显(P<0.05)。DSS显著提高了NOS1蛋白含量,降低了抗氧化蛋白NRF2含量(P<0.001)(图6F)。与NC组相比,DSS组在结肠中表现出NLRP3炎症复合物和凋亡标志物Gasdermin
D(GSDMD)的激活(P<0.001)(图6F),而BBE干预组明显表现出对NLRP3/GSDMD细胞凋亡的抑制作用,表明BBE阻断了由过度氧化应激引起的各种炎症功能障碍。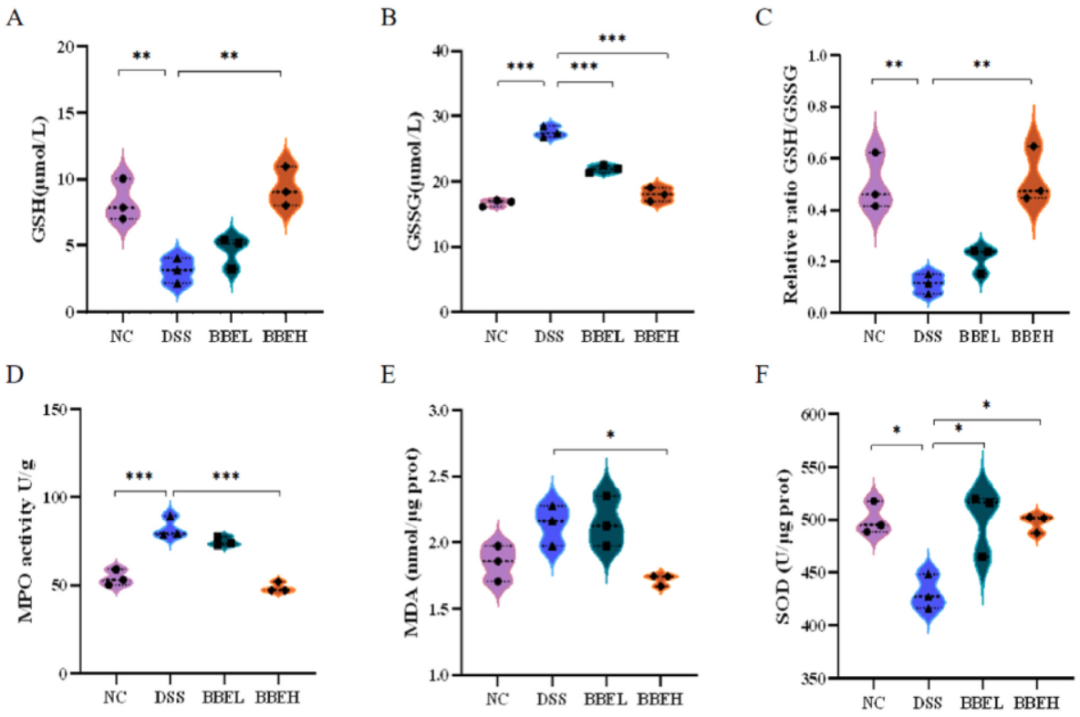
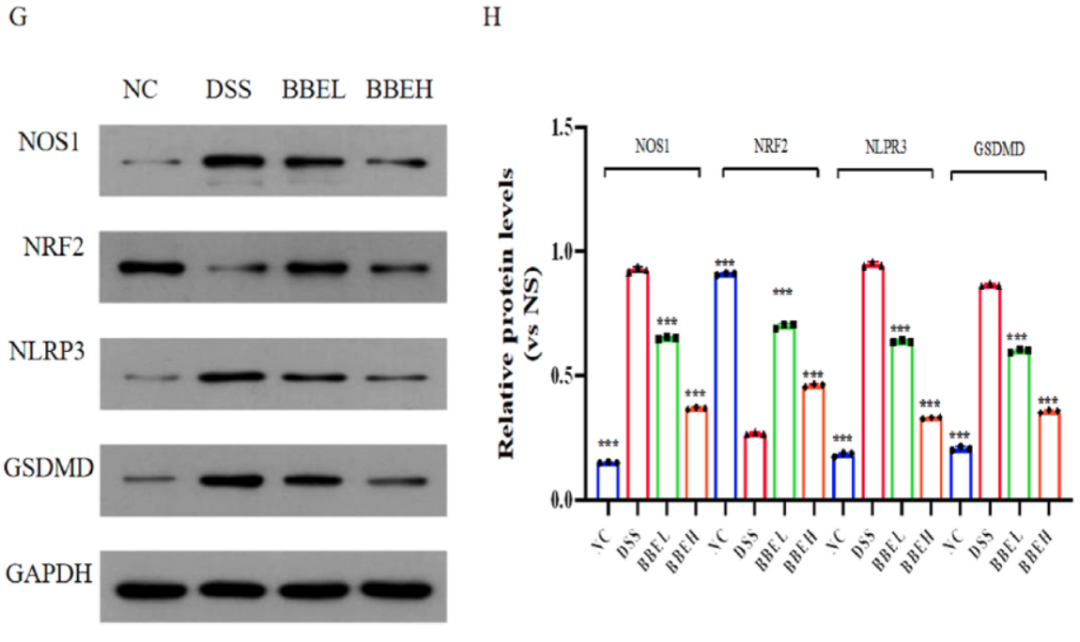
图6 BBE对结肠炎小鼠氧化应激的抑制作用。GSH(A)、GSSG(B)、GSH/GSSG(C)、MPO(D)、MDA(E)和SOD(F)的表达水平。通过western
blotting (G)分析NOS1、NRF2、NLPR3和GSDMD的表达情况。将NOS1、NRF2、NLPR3和GSDMD的相对光密度归一化为GADPH(F)
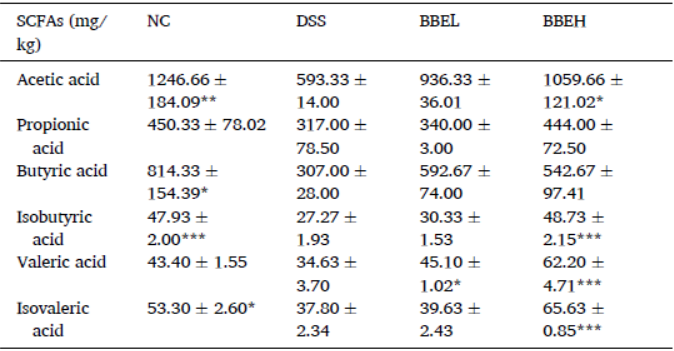
与NC组相比,DSS组结肠中乙酸、丁酸、异丁酸和异戊酸含量显著下降(表1)(P<0.05),丙酸和戊酸含量也有所降低。然而,BBE干预组显示出结肠中乙酸、异丁酸、戊酸和异戊酸水平的明显增加(P<0.05)。BBEH的改善效果明显强于BBEL(200 mg/mL BBE)。表1 小鼠肠内SCFAs的质量浓度
通过16s rRNA基因测序评估BBE对肠道菌群多样性和结构的影响。如图7A和B所示,与DSS组相比,BBE干预组Shannon和Simpson指数明显增加,但差异不明显(P>0.05)。根据主成分分析,PC1和PC2分别为36.95%和23.39%(图7C)。在门水平上,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和变形菌门(Proteobacteria)的相对丰度发生了显著变化。DSS显著提高了疣微菌门(Verrucomicrobiota)和变形菌门(Proteobacteria)的丰度,降低了Firmicutes和Bacteroidota的丰度。但这些结果在BBE干预后得到改善(图7D)。此外,在属水平上,通过直方图和线性判别分析效应大小分析观察到NC组和BBEH组以及DSS组和BBEH组之间的分类群(图7E和F)。在BBE干预后,厚壁菌属(Firmicutes)、Muribaculaceae、梭菌属(Clostridia)和乳杆菌属(Lactobacillus)的相对丰度显著增加。上述结果表明,BBE显著恢复了DSS处理小鼠肠道菌群的变化。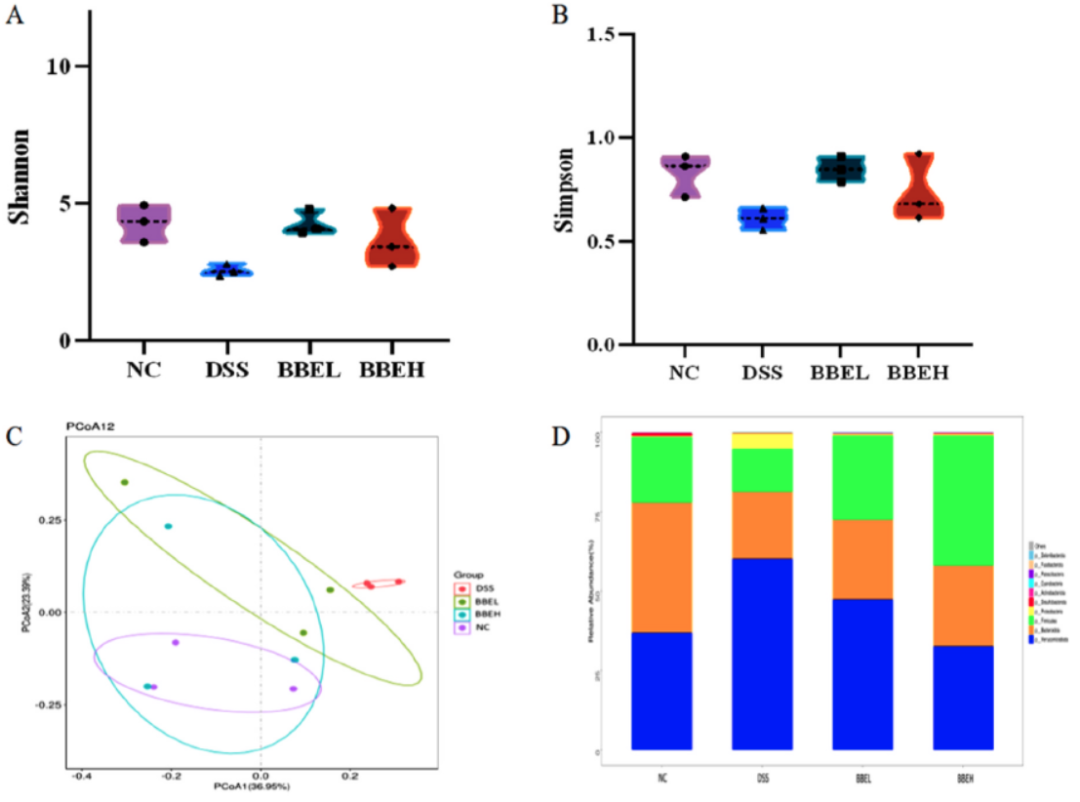
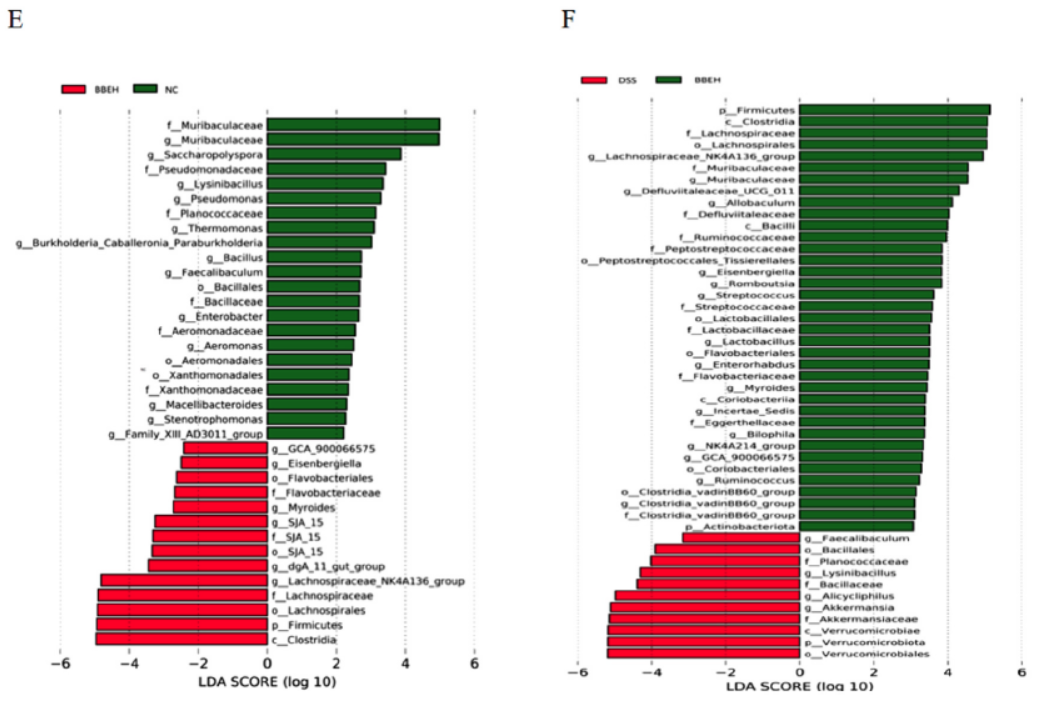
图7 BBE干预后小鼠结肠肠道菌群的变化。Shannon指数(A)、Simpson指数(B)、主成分分析(C)、门水平(D)的比较,以及OTU水平上微生物群中NC和BBEH(F)、DSS和BBEH(G)的线性判别分析效应量(LEfSe)分析
Escherichia-Shigella、Akkermansia、Bacteroides、Lactobacillus、Clostriodia_Ucg-014、Romboutsia、Muribaculaceae、Turicibacter和Alistipes是具有主要相关性的微生物群(图8A)。BBE组肠道微生物变化的相关分析(图8C)显示,Muribaculaceae、Turicibacter、Clostridia_Ucg-014和Lactobacillus的丰度与Escherichia-Shigella的丰度呈负相关。结果表明,BBE可以通过改善益生菌对病原菌的拮抗作用来维持肠道内稳态。对肠道菌群功能的预测(图8B)预示着BBE干预会下调结肠炎小鼠的LPS生物合成和氧化磷酸化。SCFAs受到包括Romboutsia和Turicibacter在内的属的正调控。此外,Muribaculaceae、Prevotellaceae、Lachnospiraceae和Ruminococcus正调节黏液蛋白(muc-2)和TJ蛋白(ZO-1和Occludin),负调节结肠炎症因子(IL-6、IL-1β和TNF-α)、氧化应激因子(NOS1和GSSG)和细胞焦亡因子(NLPR3和GSDMD)。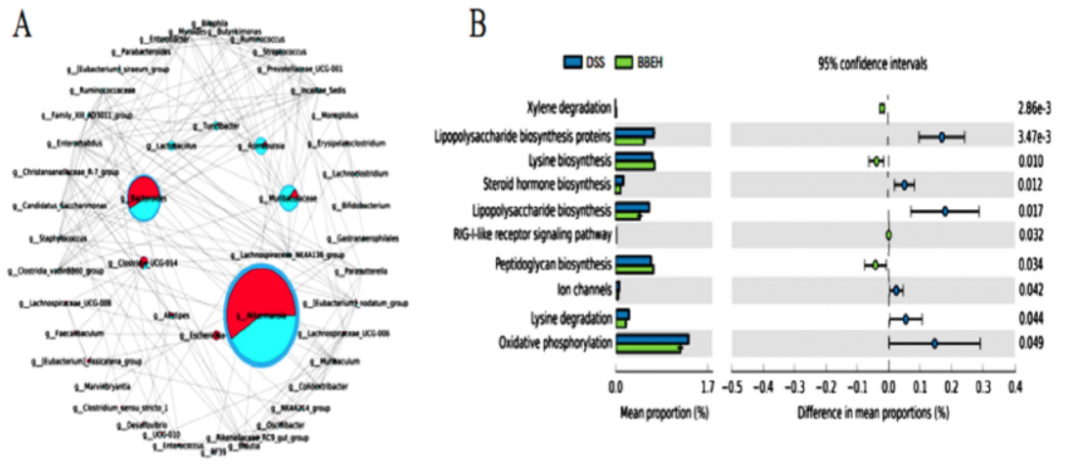
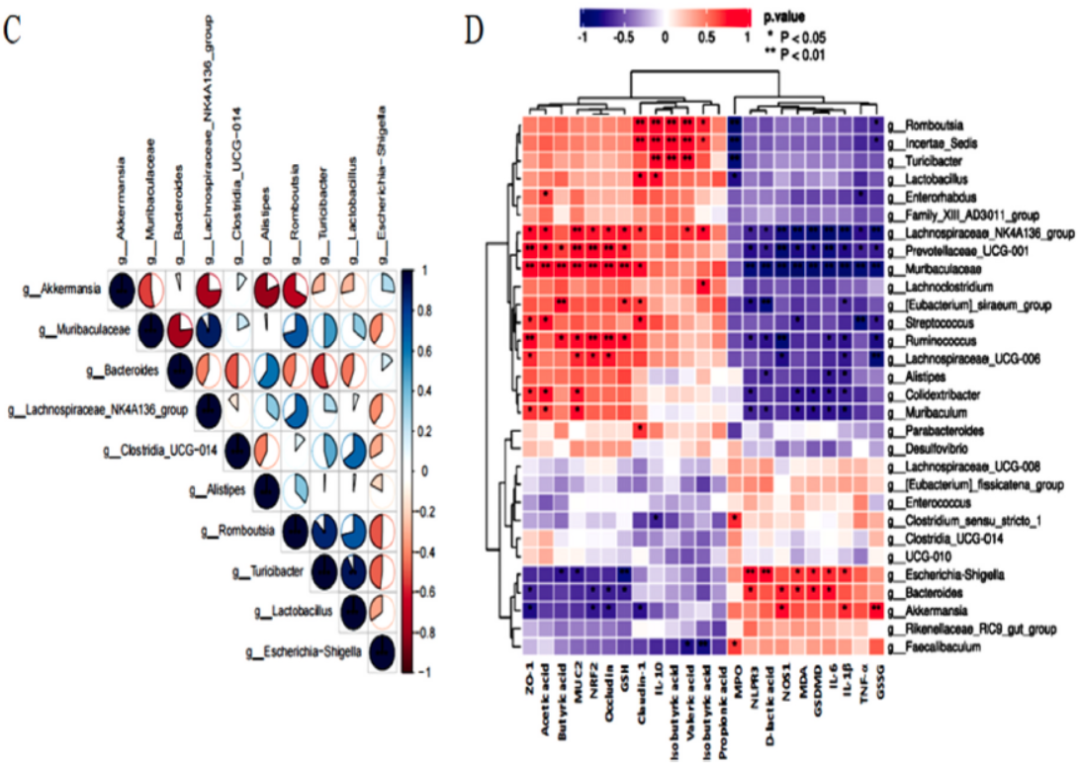
图8 BBEH组与DSS组微生物菌群水平分析(A)、肠道菌群功能预测(B)、肠道菌群变化相关分析(C)、前30 名菌群水平生化指标与微生物群多重相关性变化(D)
综上所述,从B. breve H4-2中分离得到的BBE由甘露糖、鼠李糖、葡萄糖、乙酰氨基葡萄糖和半乳糖组成,比例为1.00:0.76:1.79:1.03:0.63。BBE含有3.37%的硫酸盐基团,具有立体螺旋结构。BBE能有效修复H2O2诱导的IEC-6细胞损伤。BBE还通过抑制氧化应激、修复机械屏障、增加SCFA和抗炎(IL-10)水平、抑制促炎(TNF-α、IL-6、IL-1β)含量和调节肠道微生物群来减轻DSS诱导的小鼠结肠炎。本研究表明,BBE可以作为一种新兴的抗炎物质用于IBD的治疗。在未来的研究中,我们将结合纯化和光谱分析技术,明确BBE的具体活性成分和结构特征。文章《Exopolysaccharide from Bifidobacterium breve alleviate dextran sulfate sodium-induced colitis in mice via inhibiting oxidative stress and regulating intestinal flora》发表于Food Bioscience 2023年56卷文章链接:https://www.sciencedirect.com/science/article/abs/pii/S2212429223006715

孟祥晨,东北农业大学乳品科学教育部重点实验室/食品学院教授、博士生导师,食品发酵工程二级学科带头人,乳品科学教育部重点实验室乳品微生物及生物技术平台首席专家。爱尔兰UCC大学访问学者,美国犹他州立大学高级访问学者。中国畜产品加工研究会常务理事;国家食品药品监督管理局食品安全专家;中国奶业协会理事;农业部农产品加工标准化技术委员会委员。主要从事乳品科学与技术,食品微生物与生物技术,食品发酵等领域的教学和科研工作。先后主持、参加国家自然科学基金、教育部创新团队、“863”项目、国家科技支撑、省市各类课题20 余项,获各级各类奖励8项。获授权专利10 余项,转让科技成果2 项。出版专著和教材10 余部,发表学术论文200 余篇。
新刊启动| Food Science of Animal Products《动物源食品科学》(英文),欢迎投稿
Food Science of Animal Products(ISSN: 2958-4124, e-ISSN: 2958-3780)是一本国际同行评议、开放获取的期刊,由北京食品科学研究院、中国肉类食品综合研究中心主办,中国食品杂志社《食品科学》编辑团队运营,属于食品科学与技术学科,旨在报道动物源食品领域最新研究成果,涉及肉、水产、乳、蛋、动物内脏、食用昆虫等原料,研究内容包括食物原料品质、加工特性,营养成分、活性物质与人类健康的关系,产品风味及感官特性,加工或烹饪中有害物质的控制,产品保鲜、贮藏与包装,微生物及发酵,非法药物残留及食品安全检测,真实性鉴别,细胞培育肉,法规标准等。https://www.sciopen.com/journal/2958-4124